Fonctionnement détaillé des batteries lithium-ion
- Principe et notions de base
- Comment fonctionne la recharge ?
- Fonctionnement de la décharge
- Repères chiffrés utiles
- Gestion électronique: le BMS
- Courants de charge: C-rate et “taper”
- Température et performances
- Vieillissement: cycle et calendaire
- Chimies: rappel express
- Sécurité et thermique
- Formats de cellules
- Bon usage pour durer

La batterie au lithium-ion est ni plus ni moins que la pierre angulaire de la voiture électrique. En effet, c'est grâce à cette technologie d'accumulateur que la "voiture 2.0" a pu voir le jour, car les batteries au plomb n'avaient pas suffisamment de densité énergétique pour être viables (trop encombrantes et lourdes pour les besoins qui s'élèvent ici en dizaines de kWh).
A lire aussi en complément : les différents types et chimies de batteries lithium-ion (cobalt, manganèse, nickel, fer, phosphate ..)
(Si vous souhaitez aller directement aux explications du fonctionnement scrollez vers la bas dès maintenant).
Notez d'ailleurs pour l'anecdote que le plomb est le métal le plus lourd tandis que le lithium est le plus léger (voir le tableau périodique des éléments), c'est donc en grande partie pour cette raison qu'à puissance égale les batteries au plomb et au lithium sont très différentes en terme de poids et de volume, avec un avantage décisif pour la batterie au lithium donc.
Nous allons voir dans cet article comment fonctionnent les batteries au lithium en tentant de trouver un compromis entre approfondissement et vulgarisation, ce qui est un jeu d'équilibriste pas toujours évident à faire. J'invite d'ailleurs les connaisseurs à participer en bas de page si cela leur semblait nécessaire (les internautes apportent souvent beaucoup de valeur ajoutée, car certains sont de vrais spécialistes sur les sujets abordés, merci à eux au passage).

Principe et notions de base
Comme dans tout type de batterie (qu'on devrait plutôt nommer accumulateur à partir du moment où elle est réversible), le principe reste le même : à savoir extraire de l'énergie (ici de l'électricité) à partir d'une réaction chimique. Il faut savoir que toute réaction chimique est animée par les charges électriques des particules élémentaires qui sont souvent positives (protons etc.) ou négatives (électrons etc.), à défaut d'être neutres (neutron). Ici on va donc exploiter des réactions dites d'oxydoréduction, à savoir des oxydations et des réductions de certains matériaux. Attention, le nom est trompeur, réduction n'a rien à voir avec la perte ou l'amenuisement de quoi que ce soit, la réduction signifie que l'atome ou la molécule dont on parle gagne des électrons. L'oxydation, terme déjà plus cohérent, consiste à l'inverse à perdre des électrons.
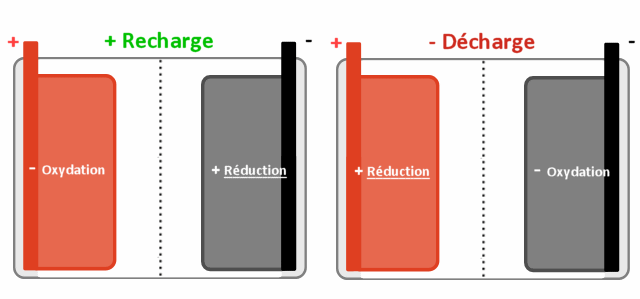
Quand un des pôles (+ ou -) s'oxyde, l'autre se réduit et vice versa selon qu'on charge ou décharge la batterie.
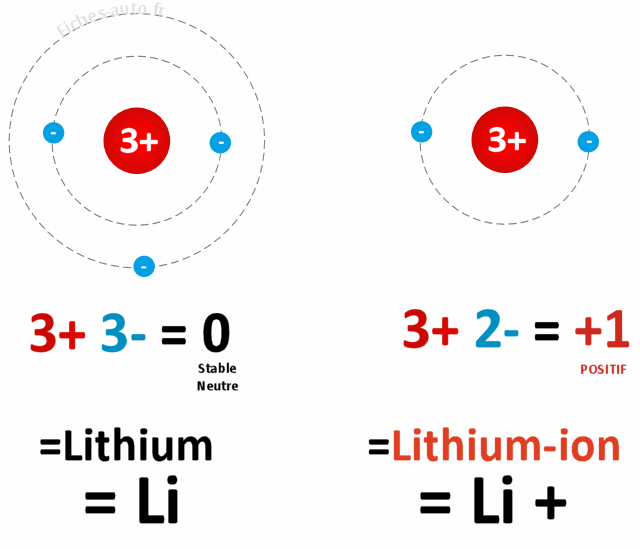
Le principe ici se limite à exploiter l'atome de lithium qui se compose de 3 protons et 3 électrons. On a choisi ce dernier car il a comme particularité d'avoir un électron un peu baladeur, à savoir qu'on peut lui piquer assez facilement un des trois électrons sans qu'il n'y ait de résistance. Et pour vulgariser et simplifier au maximum, la batterie au lithium consiste à piquer un électrons à des millions d'atomes de lithium afin de générer un courant (un courant électrique représente le mouvement des électrons dans un matériaux conducteur).
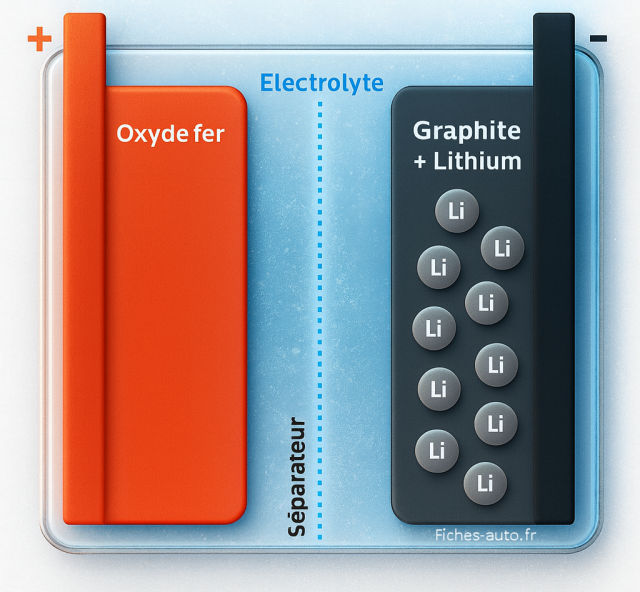
Tout d'abord il y a deux pôles (les électrodes) que l'on nomme cathode (borne +) et anode (borne -). Ces pôles/électrodes vont s'échanger de la matière (les fameux atomes de lithium à qui il ne reste que deux électrons) et de l'électricité (les électrons) lorsque l'on va utiliser la batterie, et ceci est conçu et ordonné afin de pouvoir rendre les choses réversibles : charger et décharger.
Chacun de ces pôles peut interagir avec l'autre dans une sorte de circuit logique : les électrodes vont permettre des échanges d'électrons et l'électrolyte l'échange d'atomes (on met une barrière pour éviter que les électrons ne passent par l'électrolyte). C'est l'oxydation de l'électrode négative composée de graphite de lithium qui va induire l'émission de courant.
Mais vous allez comprendre tout cela de manière plus claire quand nous allons expliquer le fonctionnement la batterie lors des charges et décharges.
.jpg)
Voici la disposition dans une cellule individuelle dont la "topologie" tend vers un enroulement
Notez que la batterie est composée de plusieurs cellules, dont chacune est formée par ce que l'on peut voir sur les schémas. Si par exemple je cumule 2 cellules de 4 volts, j'ai un total de 8 volts en sortie de batterie (branchement en série et non parallèle, car dans le deuxième cas on resterait à 4 volts). Et ici nous allons voir comment fonctionne une cellule seule.

Comment fonctionne la recharge ?
A lire aussi : les constituants d'une batterie lithium ion et leur utilité
Phénomène de recharge : les grandes lignes
.jpg)
Quand une batterie est déchargée elle est stable, à savoir qu'il n'y a pas de différence de potentiel (tension) entre les bornes + et -. Le lithium est du côté de la cathode (+) et à l'anode on a simplement du graphite (carbone disposé en plaques superposées dans lesquelles on pourra y "ranger" du lithium. Cette disposition et cette manière d'arranger les atomes de carbone s'appelle graphite)
La recharge va donc consister à créer un état instable entre + et - (un peu comme quand je tend la corde d'un arc, il me faut de la puissance), et pour cela il va falloir de l'énergie : celle de la prise sur laquelle on va se brancher et qui va nous fournir de l'électricité.
Cette électricité va être employée pour arracher les atomes de lithium de la borne + pour les envoyer vers la borne -. En réalité cela se fait de manière indirecte, car je vais plutôt arracher des électrons des atomes de lithium sur la borne + pour les envoyer vers la borne -, ce qui va induire que les atomes de lithium (qui ont perdu un électron, celui que je viens de leur arracher) ionisés (positifs) vont être attirés vers la borne - (là où il y a tous mes électrons négatifs). Une fois que mes atomes de lithium sont situés dans l'électrode - j'ai alors un déséquilibre entre les pôles + et -, et c'est ce déséquilibre chimique instable qui génère ma tension / mon voltage. Car les atomes de lithium veulent revenir vers l'oxyde de fer côté + pour retrouver une stabilité chimique.
En résumé, j'aspire des électrons côté + pour les envoyer côté -, ce qui me coûte de l'énergie. Cela rend les atomes de lithium côté cathode positifs car je leur ai pris un électron négatif. En étant positifs ils sont attirées vers le pôle - qui est chargé négativement : + et - s'attirent.
Le résultat est un état instable qui voudrait justement retrouver son équilibre, à savoir retourner à l'état initial : c'est ce qui se produira lors de la décharge.
Fonctionnement détaillé de la recharge
.gif)
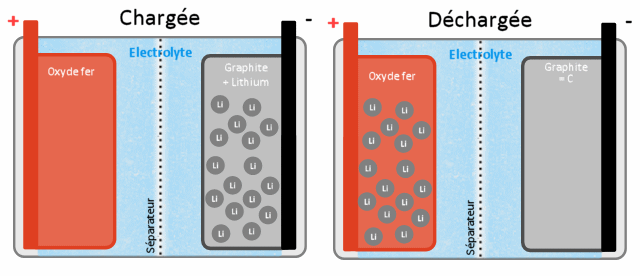
Déchargée, la batterie n'offre plus de différence de potentiel entre les pôles, il n'y a donc pas de + et de -
Quand la batterie est à plat ou neuve (avant sa commercialisation bien évidemment) il n'y a pas de voltage (tension / différence de potentiel) entre les pôles + et -. C'est d'ailleurs comme ça qu'on mesure la charge d'une batterie, à savoir combien de volts il y a entre + et -. Les atomes lithium d'une batterie neuve avant sa première recharge sont introduits en majorité dans l'électrolyte et dans une moindre dans la cathode (+).
Dans le cas d'une batterie déchargée, on est donc sur un état stable, le plus stable que la batterie puisse connaître. C'est tellement stable qu'elle ne produit aucun phénomène particulier ...
On a beau vouloir y brancher quelque chose, aucun électron (= électricité) n'y passera, car il n'y a aucune différence de potentiel entre + et -, le tout est à l'équilibre telle une pierre inerte.
.gif)
Notez que la toute première charge d'une batterie (faite en usine) induit une perte de 5% à 10% du lithium. Ce dernier va en effet générer une couche chimique dite SEI (Solid Electrolyte Interphase) qui se compose d'une partie de l'électrolyte et du lithium. Cette couche va se former sur les électrodes offrir une fonctionnalité très importante pour le fonctionnement de la batterie : des électrons seuls ne peuvent pas la traverser, ce qui veut dire qu'ils ne pourront s'échapper que par les anodes et cathodes (connecteurs de la batterie). Cette couche s'apparente alors à une sorte d'électrolyte solide qui filtre les électrons mais laisse passer les atomes ionisés. Son rôle est donc assez similaire que le séparateur qui cloisonne les cathode et anode, qui a donc pour but de ne pas laisser passer les électrons mais aussi d'éviter tout court circuit dangereux au sein de la batterie (ça sert donc à forcer les électrons à passer par un autre chemin, celui du fil électrique connecté aux pôles de la batterie).

Mais revenons à des choses plus concrètes.
La borne + est incarnée par un oxyde de métal dans lequel viennent se confondre les atomes de lithium. Ils sont ici dans un état stable car l'oxyde de métal est un milieu qui est favorable à la stabilité du lithium (dans l'air ou dans l'eau il ne l'est pas et il va réagir avec eux de manière vigoureuse, c'est pour ça qu'il ne faut pas ouvrir une batterie).
Recharger la batterie consiste à oxyder la cathode, à savoir lui faire perdre des électrons et de la matière.
La borne - est incarnée par des couches de graphite (carbone rangé en couche) empilées qui auront un rôle très simple, à savoir servir "d'étagère" pour stocker les atomes de lithium et les électrons qu'elle va recevoir. Car au moment de la charge, on cherche finalement à envoyer du lithium sur ces dernières (lithium qui a été coupé en deux : un électron et un lithium-ion), lithium qui provient du côté plus (cathode).
Recharger la batterie consiste donc à réduire l'anode (attention ! Réduire ne veut pas dire réduire en chimie ... Cela veut dire ajouter des électrons, c'est trompeur). On a alors une anode constituée de graphite de lithium.
Nous sommes donc à la base (batterie déchargée) dans un état stable où le lithium avec ses 3 électrons est du côté de la cathode (+), nous allons alors procéder comme nous l'avons dit à l'envoi des atomes de lithium vers l'anode (-). Mais les atomes de lithium ne vont pas être envoyés de ce côté en un seul morceau, il va y avoir une "découpe".
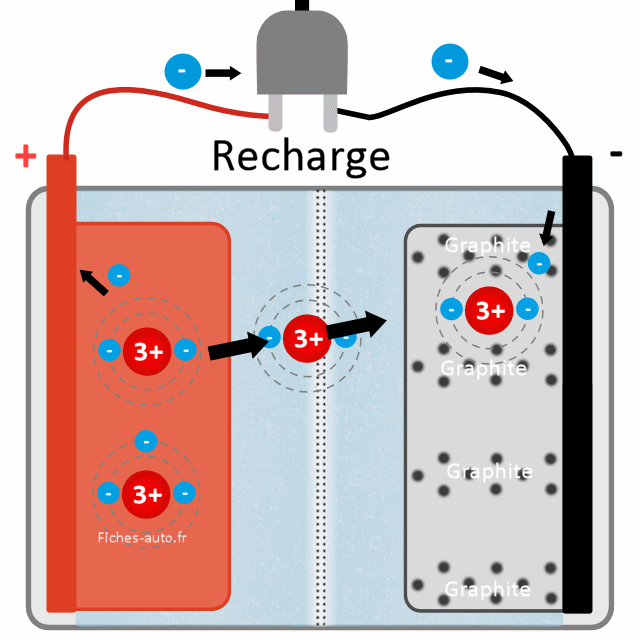
Voici une vue un peu plus détaillée du phénomène. Il faut donc ici forcer le passage des lithium vers l'anode (-), et pour cela nous allons utiliser l'énergie de la prise électrique (qui "aspire" les électrons côté + et en injecte côté -). On remet donc ici les choses à l'état initial (batterie chargée) en effectuant une réaction chimique qui utilise comme levier des électrons
Pour faire simple, le fonctionnement de la recharge consiste à injecter (quand on branche la batterie à une prise ou un alternateur) des électrons (-) dans les couches de graphite côté anode (-). C'est la borne (-) du chargeur (prise ou autre) qui s'occupe d'introduire des électrons à l'anode tandis que la borne (+) du chargeur connectée à la borne (+) de la batterie va quant à lui aspirer (attirer) des électrons (-) du côté de la cathode.
Pour résumer, la recharge consiste à envoyer des électrons du côté (-) et en aspirer du côté (+). Les électrons aspirés sont arrachés aux atomes de lithium qui sont dans l'oxyde de métal côté anode (+), ce qui induit que les atomes de lithium ne sont plus stables. En effet, au lieu d'avoir 3 protons (+) et 3 électrons (-), il n'y a plus que 2 électrons : le total est donc positif (+) car il y a 3 + et 2 -, le + gagne donc la partie. Sachez qu'on appelle alors ce type d'atome un ion, car il n'est plus équilibré en terme de charge (c'est même un cation car il est positif, même racine que pour cathode).
Ces fameux atomes de lithium qui ont été "scalpés" de leur troisième électron sont alors chargés positivement comme on vient de le dire (ce sont des ions positifs, et donc des cations). Ils vont alors être attirés côté anode puisque cette dernière est pleine d'électrons chargés négativement.
Fonctionnement de la décharge
.jpg)
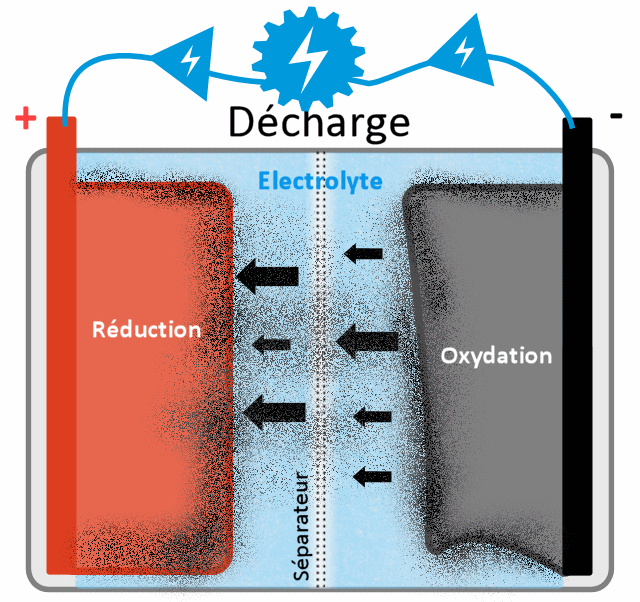
Phénomène de décharge : les grandes lignes
.gif)
Voici une batterie chargée qui a une différence de potentiel chimique important entre + et -, son état est instable et elle cherche à le retrouver (les atomes lithium veulent revenir dans l'oxyde de fer par attraction) ... Et c'est lors du processus qui vise à retrouver son état stable que la batterie va offrir des électrons
La décharge consiste à laisser les composants chimiques de la batterie revenir à un état stable. A l'inverse la recharge a eu comme rôle de rendre les choses instables, comme quand je tend la corde d'un arc : elle ne veut qu'une chose, revenir droite dès que je la lâcherai.
Mais pour que le processus puisse se faire il faut que je lâche la corde pour reprendre l'exemple de mon arc, et pour cela il faut que j'autorise les électrons à passer du - vers les + : cela se fait en connectant les bornes + et - (sur le chemin j'y mets donc des accessoires électriques : un moteur, de l'électronique, bref tout ce qui a besoin d'être animé dans notre voiture électrique).
Les électrons passent par le fil électrique car le séparateur et la couche SEI empêchent le passages des électrons via l'électrolyte.
Fonctionnement détaillé de la décharge
Le fonctionnement de la décharge d'une batterie au lithium revient donc à faire le chemin inverse de la recharge, sauf qu'ici je n'ai pas besoin d'énergie (c'est justement le but, que ça en délivre !), je vais profiter de la réaction d'oxydoréduction (nom qui définit la réaction chimique, avec d'un côté une réduction [ajout d'électrons] et de l'autre côté une oxydation [perte d'électrons]). A la base les ions lithium et les électrons côté - voudraient bien traverser ensemble l'électrolyte en direction de la cathode (+) (pour retrouver une stabilité chimique dans l'ensemble de la batterie, à savoir un voltage de 0), mais on a mis une barrière artificielle pour ne pas que ça se produise. Pourquoi ? Car dans ce cas, même si je ne branche rien à ma batterie elle se déchargera toute seule, et je n'aurai aucun moyen de tirer de l'électricité. Le but est quand même que la batterie n'offre du courant (et ne se décharge) que quand je veux lui prendre de l'énergie, mais aussi de pouvoir capter sur un fil électrique les électrons seuls. Le séparateur empêche donc les électrons de passer, seuls les atomes lithium ionisés (cations) qui ont perdu un électron peuvent passer par là. Il ne reste donc qu'un seul choix pour les électrons, passer par le deuxième chemin, à savoir le fil électrique qui relie les bornes + et -.
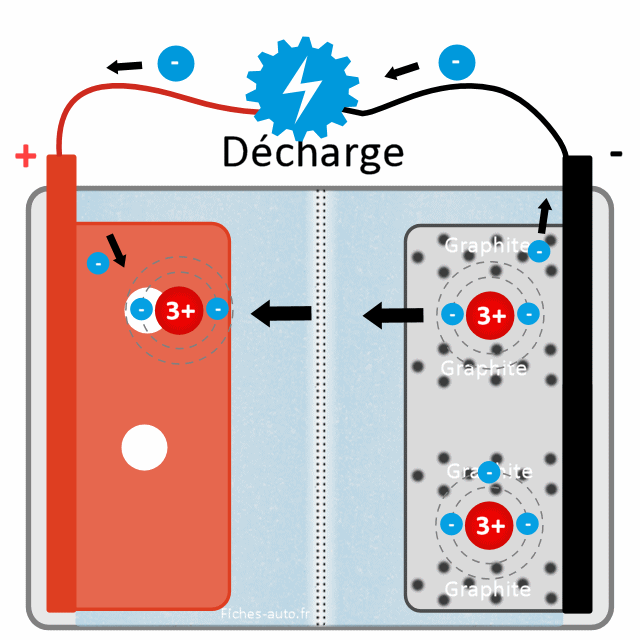
L'oxydation du graphite de lithium ne peut se faire que si il arrive à se débarrasser d'électrons. Et cela ne peut se faire que si les bornes + et - sont connectées (quand je tire sur la batterie), car les électrons n'arrivent pas à passer la couche SEI et le séparateur central
Cette fois-ci ce sont donc les ions lithiums (+ / cations) qui sont attirés vers la cathode (+) dans laquelle se situe l'oxyde de fer (c'est de là où ils venaient avant de recharger la batterie). Ils sont toutefois bloqués par le fait qu'il y a des électrons (-) dans l'anode qui les retient. Les ions lithium sont chargés positivement (+) et les électrons négativement (-), ces derniers retiennent donc le lithium du côté (-) par attraction (le + attire le -).
Cependant, si je branche quelque chose, à savoir que je décharge la batterie en alimentant un moteur électrique, je vais créer un pont entre les + et le - sur lequel les électrons pourront passer. En perdant des électrons, l'anode perdra de la force pour retenir les ions lithium et ils finiront donc par aller vers le côté (+) en passant par l'électrolyte et la paroi. Car les lithium ions n'ont qu'une obsession : revenir vers l'oxyde de fer côté + / cathode afin de retrouver un équilibre chimique stable (ce qui se produit quand je lâche la corde de mon arc : émission d'énergie pour atteindre une stabilité, à savoir la corde droite sans tension supplémentaire).
.gif)
Le même schéma que précédemment mais avec plus de détails. La batterie cherche à retrouver son état stable en envoyant des atomes de lithium ion (avec deux électrons seulement) et des électrons (le troisième qui manque) en direction du + dans lequel l'oxyde de fer attire les lithium
Cette fois on a une oxydation côté anode et une réduction côté cathode, l'inverse de la recharge.
Plus l'anode perd des électrons et des ions lithium, plus le voltage baisse. Et au bout du compte on se retrouve avec une batterie à plat qui n'offre plus aucune tension différentielle entre + et -.
Repères chiffrés utiles
Tension nominale d’une cellule Li-ion NMC/NCA: 3.6 à 3.7 V. Pleine charge: ~4.2 V. Plancher conseillé: ~3.0 V (le BMS coupe avant pour ne pas abîmer). LFP: 3.2 V nominal, ~3.6 V pleine charge, plateau de tension très plat.
Densité énergétique typique en automobile: NMC/NCA 220 à 280 Wh/kg et 550 à 750 Wh/L au niveau cellule; LFP 140 à 190 Wh/kg et 300 à 450 Wh/L. Au niveau pack, retrancher 25 à 40% selon structure, refroidissement, BMS, crash-box.
Rendement charge/décharge: 90 à 96% selon chimie, température et courant (les pertes s’appellent IR-drop et chauffent la cellule).
Gestion électronique: le BMS
Le BMS surveille tension, courant, température et équilibre les cellules. C’est lui qui impose la fenêtre d’usage: typiquement 10 à 90% pour la longévité. Il coupe en cas de surtension (surcharge), sous-tension, sur-courant ou sur-chauffe.
Équilibrage des cellules: passif par résistances (le plus fréquent) ou actif (transfert d’énergie). Un pack mal équilibré perd de l’autonomie en haut et en bas de courbe, et vieillit plus vite.
Courants de charge: C-rate et “taper”
Le C-rate est un courant relatif: 1C = courant égal à la capacité. Exemple: cellule de 50 Ah, 1C = 50 A. Les charges rapides DC en automobile sont souvent 1 à 3C en crête. Le “taper” réduit la puissance dès ~40 à 60% (selon pack) pour limiter tension et température; c’est pourquoi 10 à 80% est bien plus rapide que 80 à 100%.
Température et performances
Fenêtre optimale: environ 20 à 35°C. À 0°C, la résistance interne augmente, la puissance dispo chute et la charge rapide est limitée. En dessous de ~5°C, de nombreux BMS réduisent la puissance de charge; pré-chauffage pack indispensable pour retrouver un bon débit. À >45°C, le BMS bride aussi pour protéger la chimie.
Vieillissement: cycle et calendaire
Le SOH (state of health) baisse avec le temps (calendaire) et l’usage (cycles). Les facteurs aggravants: haut SOC prolongé (>90%), forte température, charges rapides répétées et courants élevés à froid. Ordre de grandeur auto: 70 à 80% de capacité résiduelle après 160 à 250 kkm est courant, LFP tenant souvent mieux aux cycles mais moins dense.
Chimies: rappel express
NMC/NCA: haute densité, bonne puissance, sensible aux hautes températures et aux surcharges. LFP: densité plus faible mais grande stabilité thermique, profil tension très plat, très bonne longévité; idéal flotte/urbaine. Manganèse riche (NMC haut Mn) et LFP-M: compromis coût/sécurité en hausse.
Sécurité et thermique
La SEI se forme surtout à la première charge et continue de s’épaissir lentement avec l’âge. Une surchauffe peut déclencher emballement thermique; les packs auto ont multiples barrières: surveillance multi-sondes, fusibles pyro, compartimentage, refroidissement liquide, évents de décompression. La prévention joue plus que la guérison.
Formats de cellules
Cylindriques (18650, 21700, 4680): excellente reproductibilité, bonne gestion thermique unitaire. Pouch: densité volumique élevée, nécessite compression mécanique et contrôle thermique soignés. Prismatiques: modules compacts, intégration pack simple, inertie thermique plus importante. Les architectures “cell-to-pack” réduisent le pourcentage de “matériel mort”.
Bon usage pour durer
Éviter longs stationnements à 100% ou sous 10%. Privilégier charges lentes au quotidien, garder les charges rapides pour les trajets. Pré-conditionner avant charge rapide par temps froid. Sur dimensionner un peu la batterie dans l’usage réel permet de rester dans la zone douce 20-80% sans se priver. Une gestion sage peut diviser par deux la dégradation annuelle.
Ces articles pourraient vous intéresser :
- Bien choisir une batterie de voiture
- Durée de vie des batteries lithium-ion de voiture électrique
- Comparatif du rendement entre hydrogène et batterie lithium
- Voiture électrique : quelle taille de batterie choisir ?
- Le vieillissement et la dégradation des batteries au lithium
- Composition d'une batterie au lithium
- Recalibrer la batterie voiture électrique
- Pourquoi faut-il préchauffer sa batterie avant une charge rapide ?
- Comment le BMS mesure le niveau de charge d'une batterie ?
- L'histoire de la batterie lithium
- Comment une batterie lithium peut prendre feu ?
- Batterie voiture électrique : conséquences d'une surcharge ?
- Gestion thermique de la batterie d'une voiture électrique
- Les types de cellules lithium-ion
- Densité énergétique par type/chimie de batterie lithium-ion
- Batteries solides et semi-solides : différences
Ecrire un commentaire
Sondage au hasard :
Pour vous un contrôle technique validé c'est :
© CopyRights Fiches-auto.fr 2026. Tous droits de reproductions réservés.
Nous contacter - Mentions légales
Fiches-auto.fr participe et est conforme à l'ensemble des Spécifications et Politiques du Transparency & Consent Framework de l'IAB Europe. Il utilise la Consent Management Platform n°92.
Vous pouvez modifier vos choix à tout moment en cliquant ici.




