Supercondensateurs : fonctionnement, avantages et inconvénients
- Comment fonctionne un supercondensateur
- Ce que fait une batterie lithium-ion
- Différence structurelle ?
- Supercondensateur chargé
- Supercondensateur en cours de décharge
- Supercondensateur déchargé
- Ce que fait un supercondensateur
- Pourquoi un supercondensateur ne remplace pas une batterie
- Où les supercondensateurs ont du sens
- Avantages et inconvénients
- Deux technologies complémentaires

.jpg)
Les supercondensateurs reviennent régulièrement dans les discussions autour de la voiture électrique. Charge ultra-rapide, durée de vie énorme, robustesse impressionnante. Sur le papier, tout cela donne envie. Pourtant, ils ne remplacent toujours pas les batteries lithium classiques.
Dans l’automobile, les supercondensateurs restent une technologie très marginale. Contrairement aux batteries, ils ne sont presque jamais utilisés pour stocker de l’énergie sur la durée, mais uniquement pour gérer des appels de puissance très brefs. En pratique, leur présence se limite à quelques applications bien spécifiques, comme certains véhicules industriels soumis à des cycles de freinage et de redémarrage très intensifs, ou à des projets automobiles très haut de gamme (Lamborghini l'exploite) servant surtout de démonstrateurs techniques. Dans les voitures de grande série, y compris les hybrides légers 48V, les constructeurs s’appuient quasi exclusivement sur des batteries lithium, bien plus adaptées aux besoins réels d’un usage quotidien. Les supercondensateurs ne sont donc pas absents par manque d’intérêt, mais parce que leur domaine d’excellence reste étroit. Ils excellent dans la gestion des pics de puissance, pas dans le stockage d’énergie, ce qui explique leur adoption extrêmement limitée dans l’automobile moderne, même si le principe de fonctionnement reste particulièrement intéressant d’un point de vue technique.

Ici dans la Lamborghini Siàn
Comment fonctionne un supercondensateur
Un supercondensateur ne stocke pas l'énergie comme une batterie lithium-ion. Il n'y a quasiment pas de réaction chimique. L'énergie est stockée de manière électrostatique, à la surface des électrodes.
En pratique, les charges s'accumulent puis se libèrent très vite. C'est simple, efficace, et extrêmement rapide. C'est aussi ce qui explique à la fois les qualités du supercondensateur et ses limites.
Ce que fait une batterie lithium-ion
Une batterie lithium-ion est conçue pour stocker beaucoup d'énergie sur la durée. C'est elle qui permet à une voiture électrique de parcourir plusieurs centaines de kilomètres.
En contrepartie, elle supporte mal les charges très rapides répétées, les appels de puissance violents et les températures extrêmes. Elle vieillit avec le temps et les cycles, et finit par perdre de la capacité. Malgré tout, aujourd'hui, c'est la seule technologie capable d'offrir un compromis acceptable entre autonomie, poids et volume.
Différence structurelle ?
La différence fondamentale entre une batterie lithium et un supercondensateur se situe dans leur structure interne et dans la manière dont l'énergie est stockée. Une batterie lithium-ion repose sur des électrodes bien distinctes, une anode et une cathode, séparées par un électrolyte, et le stockage d'énergie se fait via des réactions électrochimiques. Les ions lithium se déplacent d'une électrode à l'autre et s'insèrent dans la structure des matériaux, ce qui permet de stocker beaucoup d'énergie, mais au prix de temps de charge plus longs et d'une usure progressive.
Un supercondensateur fonctionne autrement. Il possède lui aussi deux électrodes et un électrolyte, mais l'essentiel du volume est occupé par des électrodes très épaisses et extrêmement poreuses, conçues pour offrir une surface gigantesque. L'énergie n'est pas stockée par une réaction chimique, mais par accumulation de charges électriques à la surface de ces électrodes. Il n'y a quasiment pas de transformation interne, ce qui explique la charge très rapide, la durée de vie énorme et la robustesse du système. En revanche, comme le stockage se fait uniquement en surface, la quantité d'énergie stockée reste très faible par rapport à une batterie lithium. Contrairement à une batterie lithium-ion, un supercondensateur ne repose pas sur une anode et une cathode chimiquement différentes. Les deux électrodes sont généralement identiques et constituées de carbone très poreux. L'énergie n'est pas stockée dans la matière, mais à la surface des électrodes, ce qui explique pourquoi celles-ci occupent l'essentiel du volume interne.
Dans un supercondensateur, il n'y a pas de réaction chimique au sens classique. Le carbone des électrodes ne se transforme pas et ne stocke pas des ions dans sa structure, contrairement à une batterie lithium. Les électrons circulent librement dans le matériau conducteur et viennent s'accumuler à la surface des électrodes. Le carbone ne ‘capte' pas des électrons dans ses orbitales comme lors d'une réaction chimique, il porte simplement une charge électrique globale.
En face de ces électrodes chargées, l'électrolyte joue un rôle clé. Il contient des ions positifs (atome à charge positive car il manque d'électrons négatifs) et négatifs (atome à charge négative car il contient un excès d'électrons négatifs) qui se déplacent sous l'effet du champ électrique. Les ions positifs viennent se placer contre l'électrode négative, et inversement, à une distance extrêmement faible, de l'ordre du nanomètre. Il ne s'agit pas d'un contact direct, mais d'une séparation très fine entre charges opposées. C'est ce qu'on appelle la double couche électrique.
La tension entre le pôle positif et le pôle négatif provient directement de cette séparation de charges. D'un côté, un excès d'électrons, de l'autre un déficit, et entre les deux une distance minuscule mais réelle. L'énergie n'est donc pas stockée dans la matière, mais dans le champ électrique créé par cette séparation. Plus on accumule de charges à la surface des électrodes, plus la tension augmente. À l'inverse d'une batterie, cette tension varie de manière linéaire lors de la charge et de la décharge, sans plateau stable.
C'est aussi pour cette raison que la surface des électrodes est primordiale. Le carbone utilisé est extrêmement poreux, avec une surface interne gigantesque à l'échelle atomique. Chaque pore offre un nouvel endroit où les charges peuvent s'accumuler. Cela permet d'absorber et de restituer des courants très élevés, très rapidement, mais sans jamais stocker autant d'énergie qu'une batterie lithium, où l'énergie est enfermée dans des réactions chimiques profondes.
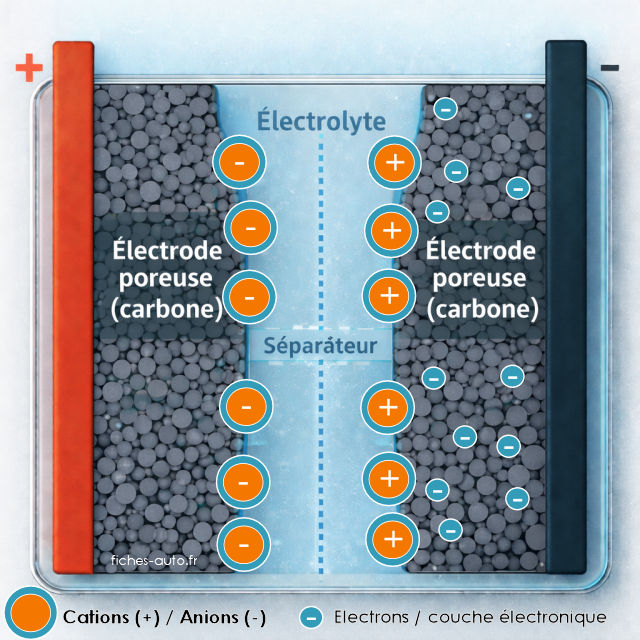
Supercondensateur chargé
Lorsque le supercondensateur est chargé, une double couche électrique est formée sur chaque électrode. L'électrode négative porte un excès d'électrons et attire des cations dans l'électrolyte, qui viennent se placer juste en face de sa surface. À l'inverse, l'électrode positive est en déficit d'électrons et attire des anions. Les charges électroniques restent dans le carbone, les ions restent dans l'électrolyte. L'énergie est stockée dans cette séparation très fine entre charges opposées.
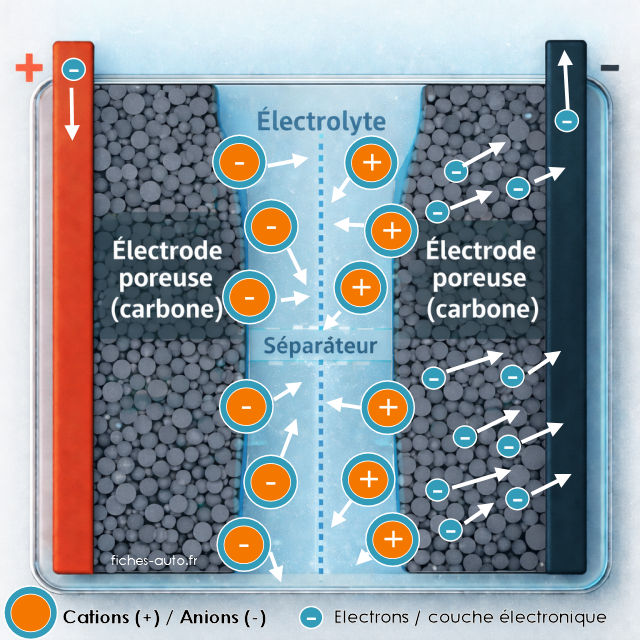
Supercondensateur en cours de décharge
Lors de la décharge, les électrons quittent l'électrode négative et circulent dans le circuit externe vers l'électrode positive. En parallèle, l'attraction électrostatique diminue, les ions commencent à se décoller des surfaces des électrodes et la double couche se défait progressivement. Les cations et anions se redistribuent dans l'électrolyte, principalement par diffusion, sans flux ionique organisé d'une électrode vers l'autre.
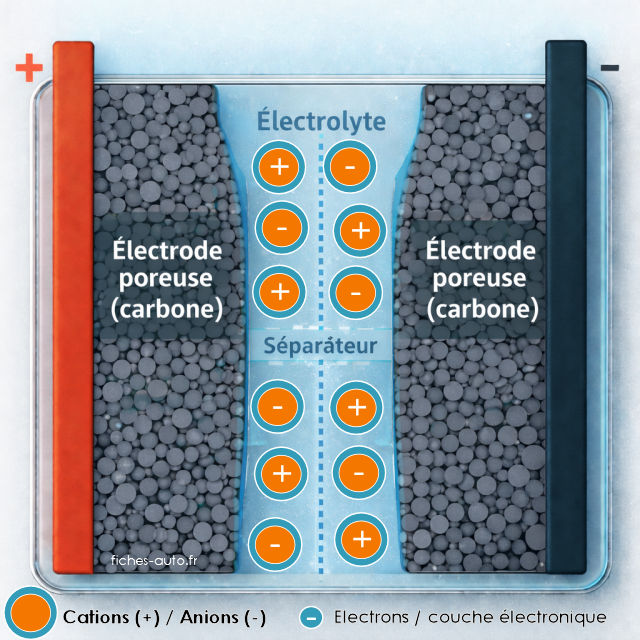
Supercondensateur déchargé
Une fois le supercondensateur complètement déchargé, les électrodes redeviennent électriquement neutres et la double couche a disparu. Les cations et anions sont alors répartis de manière homogène dans l'électrolyte, de part et d'autre du séparateur. Il n'y a plus de différence de potentiel entre les électrodes, et donc plus d'énergie stockée.
Ce que fait un supercondensateur
Le supercondensateur joue dans un autre registre. Il est très mauvais pour stocker beaucoup d'énergie, mais très bon pour gérer la puissance.
Ses points forts sont connus :
- charge et décharge quasi instantanées
- puissance très élevée
- durée de vie énorme, souvent des centaines de milliers de cycles
- très bonne tolérance aux températures
- stabilité et sécurité élevées
En revanche, la quantité d'énergie stockée reste très faible. À masse ou volume équivalent, un supercondensateur stocke plusieurs fois moins d'énergie qu'une batterie lithium-ion. C'est là que tout se joue.
Pourquoi un supercondensateur ne remplace pas une batterie
Un supercondensateur peut délivrer énormément de puissance, mais sur un temps très court. Il est incapable d'assurer une autonomie correcte à lui seul.
Dans une voiture, cela se traduit simplement. On peut améliorer les accélérations, récupérer efficacement l'énergie au freinage, lisser les appels de puissance. Mais si on s'appuie uniquement sur un supercondensateur, l'autonomie devient ridicule.
C'est pour cette raison qu'on ne les utilise jamais comme source principale d'énergie.
Où les supercondensateurs ont du sens
Les supercondensateurs deviennent intéressants quand ils sont utilisés comme tampon énergétique, en complément d'une batterie. Ils absorbent et restituent l'énergie très rapidement, là où une batterie souffrirait.
On les retrouve donc surtout :
- en complément d'une batterie, pour la soulager
- dans les systèmes de récupération d'énergie
- dans les véhicules de compétition ou très hautes performances
- dans certaines applications industrielles ou ferroviaires
Dans ces usages, ils améliorent l'efficacité globale et la durée de vie du système, sans jamais prétendre remplacer une batterie de traction.
Avantages et inconvénients
Les avantages sont clairs. Charge ultra-rapide, puissance instantanée, durée de vie énorme, très bonne stabilité thermique et sécurité élevée.
Les inconvénients le sont tout autant. Très faible densité énergétique, autonomie quasi inexistante, encombrement important à énergie équivalente, coût élevé pour l'énergie stockée. Sans une batterie à côté, ça ne fonctionne tout simplement pas.
Deux technologies complémentaires
Opposer supercondensateurs et batteries lithium n'a pas vraiment de sens. Ce sont deux technologies pensées pour des rôles différents.
La batterie stocke l'énergie et permet de rouler longtemps.
Le supercondensateur gère la puissance instantanée et encaisse ce que la batterie n'aime pas.
C'est pour ça que, malgré leurs qualités, les supercondensateurs n'ont jamais remplacé les batteries dans les voitures électriques. Ils restent très efficaces, tant qu'on leur demande ce pour quoi ils sont faits.
Ces articles pourraient vous intéresser :
- Batterie solide : différences, avantages et inconvénients
- Batteries solides : où en est-on en 2026 ?
- Batteries solides et semi-solides : différences
- Densité énergétique par type/chimie de batterie lithium-ion
Ecrire un commentaire
Sondage au hasard :
Etes-vous attiré par les locations longue durée ?
© CopyRights Fiches-auto.fr 2026. Tous droits de reproductions réservés.
Nous contacter - Mentions légales
Fiches-auto.fr participe et est conforme à l'ensemble des Spécifications et Politiques du Transparency & Consent Framework de l'IAB Europe. Il utilise la Consent Management Platform n°92.
Vous pouvez modifier vos choix à tout moment en cliquant ici.




