Mécanisme du processus de décharge d'une batterie lithium

Une batterie lithium-ion est un système chimique étonnamment simple dans son principe, mais d’une précision remarquable dans son fonctionnement. Elle transforme directement une réaction chimique en courant électrique. Pour comprendre comment elle se décharge, il faut d’abord savoir de quoi elle est faite et ce qui se passe réellement à l’échelle atomique.
Les éléments de base d’une batterie lithium-ion
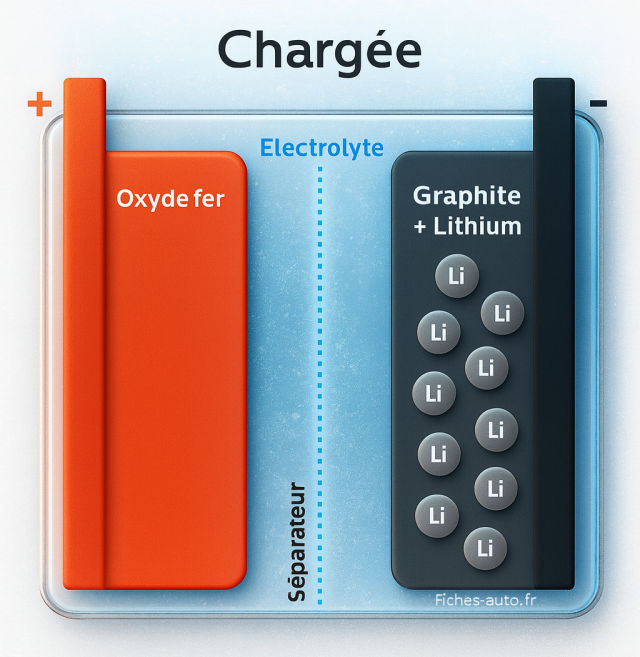
Une cellule lithium-ion se compose de trois éléments principaux :
- L’anode, souvent constituée de graphite, qui stocke les ions lithium quand la batterie est chargée.
- La cathode, composée d’un oxyde métallique (souvent à base de nickel, manganèse et cobalt, ou de fer phosphate pour les batteries LFP), qui accueille les ions lithium lors de la décharge.
- L’électrolyte, un liquide ou gel conducteur d’ions, qui permet le passage des ions lithium (Li?) entre les deux électrodes sans que les électrons ne puissent le traverser.
Un séparateur microporeux isole physiquement l’anode et la cathode pour éviter tout court-circuit, tout en laissant passer les ions à travers ses minuscules pores. C’est un équilibre subtil entre étanchéité électrique et perméabilité ionique.
Un rappel essentiel : atomes, ions et électrons
Chaque atome est formé d’un noyau (constitué de protons et de neutrons) entouré d’un nuage d’électrons. Ces électrons, chargés négativement, gravitent autour du noyau positif. Dans un atome neutre, il y a autant de protons que d’électrons, ce qui équilibre les charges.
Un ion est un atome qui a perdu ou gagné un ou plusieurs électrons.
- S’il perd des électrons, il devient positif (on parle de cation).
- S’il gagne des électrons, il devient négatif (on parle d’anion).
Le lithium, dans une batterie, fonctionne sous sa forme ionisée : Li?. Cela signifie qu’il a perdu un électron, resté du côté de l’anode. Ces électrons libres circuleront à travers le circuit externe pendant la décharge. Les ions lithium, eux, se déplacent à l’intérieur de la batterie pour équilibrer les charges.
C’est ce jeu de va-et-vient entre électrons et ions qui fait toute la magie de la batterie : les ions bougent à l’intérieur de la cellule, pendant que les électrons bougent à l’extérieur, dans le circuit électrique du véhicule.
L’équilibre chimique à l’origine de la tension
Lorsqu’une batterie est chargée, la majorité des ions lithium est logée dans le graphite de l’anode. La cathode, elle, est relativement pauvre en lithium. Ce déséquilibre entre les deux électrodes crée une différence de potentiel chimique, que l’on mesure sous forme de tension électrique.
Plus la batterie est chargée, plus ce déséquilibre est grand : la différence d’énergie entre les deux bornes s’accroît, ce qui élève la tension.
Cette tension représente en fait la force avec laquelle le système cherche à retrouver son équilibre. Une batterie pleine est comme un ressort comprimé : dès qu’on ferme le circuit, elle tend naturellement à relâcher cette énergie pour revenir à un état stable.
Le départ des ions lithium : le début de la décharge

Quand le circuit est fermé (par exemple en accélérant), la batterie se décharge. Les ions lithium quittent l’anode pour rejoindre la cathode à travers l’électrolyte. Pendant ce temps, les électrons qui accompagnaient ces atomes restent bloqués du côté de l’anode, car l’électrolyte ne laisse pas passer les charges électriques. Ils empruntent alors le circuit externe pour rejoindre la cathode, alimentant au passage le moteur ou les calculateurs.
Ce double flux — ions à l’intérieur, électrons à l’extérieur — est parfaitement synchronisé. Il permet à la batterie de fournir un courant stable tout en maintenant la neutralité électrique de chaque électrode.
À l’anode, le lithium se transforme en ion (Li?) en libérant un électron. À la cathode, ces ions reviennent se recombiner avec les électrons pour reformer du lithium neutre.
Une réaction naturelle et stable
Ce processus est spontané. La décharge ne demande aucune énergie externe, car elle va dans le sens de la stabilité chimique. Les ions lithium “descendent la pente” énergétique : ils quittent un milieu où leur potentiel est élevé pour aller vers un milieu plus stable. C’est une réaction exothermique, qui libère un peu de chaleur.
Même à basse température, le mouvement reste possible. Le froid ralentit simplement la vitesse des ions dans l’électrolyte, mais ne change pas le sens ni la nature du processus. On peut donc tirer beaucoup de puissance d’une batterie froide sans l’endommager, au prix d’un rendement légèrement inférieur.
Fin de décharge et sécurité
Au fur et à mesure que les ions quittent l’anode, le déséquilibre chimique s’atténue et la tension chute. Le courant diminue, jusqu’à atteindre le seuil de sécurité fixé par le calculateur (le BMS). Ce dernier coupe la décharge avant que les cellules ne descendent trop bas, généralement autour de 2,5 à 3,0 V par cellule. Descendre en dessous endommagerait l’anode et compromettrait la capacité future de la batterie.
En résumé
Lors de la décharge, une batterie lithium-ion transforme son énergie chimique en électricité. Les ions lithium migrent naturellement de l’anode vers la cathode, pendant que les électrons parcourent le circuit du véhicule. Ce mouvement coordonné, stable et spontané, se poursuit jusqu’à ce que la tension s’équilibre.
Le cœur du phénomène repose sur la physique la plus simple qui soit : un système déséquilibré cherchant à retrouver sa stabilité. Une batterie pleine, c’est de l’énergie “en tension” qui attend simplement de retomber vers son point d’équilibre.
Ecrire un commentaire
Sondage au hasard :
Etes-vous pour les radars automatiques ?
© CopyRights Fiches-auto.fr 2025. Tous droits de reproductions réservés.
Nous contacter - Mentions légales
Fiches-auto.fr participe et est conforme à l'ensemble des Spécifications et Politiques du Transparency & Consent Framework de l'IAB Europe. Il utilise la Consent Management Platform n°92.
Vous pouvez modifier vos choix à tout moment en cliquant ici.




