Composition d'une batterie au lithium

Découvrez dans cet article quels sont les constituants d'une batterie au lithium et quelles sont les fonctions de chaque composant. Nous allons ici essayer de rester synthétique pour éclaircir le plus possible les choses. Voici donc ce qui compose une batterie de voiture électrique couramment utilisée de nos jours.
Commençons par préciser qu'il n'y a pas de terres rares ici ...
.gif)
Lithium
Allez commençons par le composant central de ce type de batterie puisque cette dernière en reprend l'appellation : batterie lithium.
C'est en effet la pierre angulaire du mécanisme de ce type de batterie, à savoir que l'atome de lithium peut facilement vous offrir un de ses électrons, électrons qui constituent donc l'électricité qui circule dans un câble (le jus consiste donc à faire circuler des électrons, uniquement possible sur un matériaux conducteur évidemment).
Dans le cas d'une batterie déchargée, les atomes de lithium se situent du côté +, à savoir la cathode. A cet emplacement les atomes lithium sont neutres et "entiers", à savoir qu'ils ont tous leurs électrons.
Rappelons qu'un atome de lithium a un noyaux de 3 protons + et 3 électrons -, le tout résultant à une neutralité +3 -3 = 0.
Lors des recharges/décharges, le jeu consiste à passer ces atomes de lithium d'une électrode à l'autre (de l'anode vers la cathode ou l'inverse dans le cas d'une recharge).
Sachez que leur voyage ne se fera que dans un état particulier, à savoir avec 2 électrons au lieu de 3. Dans cet état où il manque un électron, l'atome devient alors positif : +3 -2 = +1.
Un atome positif ou négatif (pas neutre en tout cas) se nomme ion (anions si il est négatif et cation si il est positif), d'où le nom de batterie lithium ion et non pas lithium tout court.
Sachez enfin que les ions et atomes lithium ne sont pas voués à rester cantonnés dans une zone précise, ils se baladent d'un pôle à l'autre selon charge/décharge. Les pôles/électrodes n'auront donc pas la même constitution selon que la batterie est vide ou remplie.
Electrode + (Cathode)
C'est le plus (+) de la batterie. Cette dernière se compose de plusieurs éléments.
Il y a tout d'abord l'oxyde de fer qui représente le plus gros de la masse. Et selon le type de batterie on aura de l'oxyde de cobalt (CoO2) ou encore du phosphate de fer (LiFePO4) pour ne citer qu'eux.
Le composition sera aussi différente selon que la batterie est chargée ou pas, avec en plus du lithium ou pas. Dans le cas d'une version au phosphate de fer, on aura du FePO4 si la batterie est chargée et du LiFePO4 dans le cas où elle est déchargée (le lithium en plus : Li).
Notez que la cathode est constituée de matière active puisqu'elle aura tendance à attirer des atomes de lithium quand elle en sera dépourvue (FePO4). Les atomes de lithium permettent alors à cette matière de se stabiliser (et vice versa, le lithium devient stable dans cet oxyde de fer. En dehors il réagit et s'oxyde facilement, au contact de l'air ou de l'eau par exemple). Bref, l'association du lithium et du matériaux de la cathode rend le tout stable d'un point de vue chimique (l'un et l'autre se désirent plus que tout ! Car leur association les rend stables).
Il y a ensuite le collecteur (généralement en aluminium) qui permet de canaliser les électrons pour les diriger vers la cosse de la batterie (connecteur +) et pour collecter tous les électrons qui sont dans le reste de l'électrode (LiFePO4). En effet, le séparateur (et les couches SEI) empêche les électrons de passer d'une électrode à l'autre par le chemin de l'électrolyte. Le collecteur permet donc de tirer ou d'ajouter du courant/jus dans l'électrode concernée.
.gif)
Anode - (Anode)
L'anode est plus simple à appréhender que la cathode. Ici c'est très basique puisqu'on a simplement un arrangement de couches de carbones empilées les unes sur les autres, ce que l'on appelle graphite. Son rôle est de servir "d'étagère" pour ranger les atomes de lithium en provenance de la cathode ((lors de la recharge).
Comme pour la cathode, selon que la batterie est vide ou non la composante n'est pas la même. Batterie vide il n'y a que du carbone / graphite, à savoir C (carbone). Quand la batterie est pleine l'anode est alors constituée de carbone et de lithium : graphite de lithium (Li C).
Le collecteur est ici généralement en cuivre, et donc différent de celui de l'anode pour obtenir plus favorablement un pôle + et un pôle -.

La couche SEI qui l'entoure se génère toute seule lors de la première recharge (selon un protocole précis que le constructeur applique, ce n'est pas une banale recharge), et elle permet que la batterie fonctionne e manière contrôlée. Il s'agit d'un mélange de lithium ions et d'électrolyte (sel de lithium) qui se durcit et forme une barrière pour les électrons qui ne peuvent pas passer (si c'était le cas on ne pourrait pas collecter le courant aux bornes, le jus passerait dans la batterie / électrolyte sans qu'on ne puisse l'exploiter, et la matière interne s'oxyderait sans même qu'on utilise la batterie). La première recharge, faite en usine, consommera alors entre 5 et 10% du lithium pour former cette couche SEI (SEI = Solid Electrolyte Interphase).
Cette couche peut aussi s'épaissir avec le temps, ce qui réduit les capacités de la batterie.

Electrolyte
Ce dernier doit permettre la circulation des ions lithium (lithium où on a retiré un électron (-) : chargé positivement donc) et donc permettre de produire les oxydations (perte d'électrons) et les réductions (gain d'électrons). L'électrolyte peut être solide, liquide ou en gel.
Dans le cas de notre batterie au lithium c'est du sel de lithium mélangé à un solvant.
L'électrolyte permet donc d'établir un contact entre les anode et cathode dans le but qu'elles puissent se passer des atomes de lithium ionisés, et donc qu'il y ait la possibilité de rendre réversible l'accumulateur (dans le cas inverse c'est une banale pile).
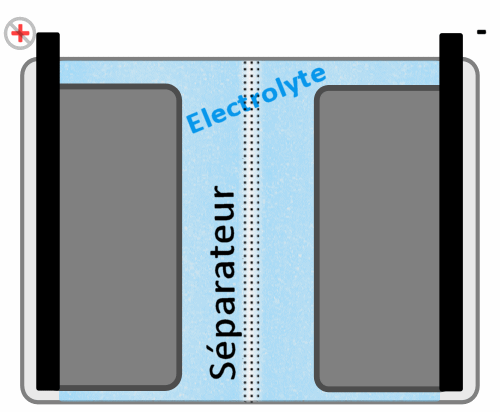
Séparateur
Doté de petits pores destinés à laisser passer les ions lithium, leur but est aussi de bloquer tout électron qui voudrait passer afin qu'ils soient forcés de le faire par les cosses de la batteries (connecteurs physiques externes). Il a aussi comme rôle d'éviter tout court circuit entre les deux pôles ou même encore d'ordonner la manière dont les ions vont passer, cela afin de bien les répartir en face sur l'autre électrode (pour éviter des concentrations à certains endroits et des vides à d'autres).
Ces articles pourraient vous intéresser :
- Fonctionnement des batteries lithium-ion
- Comparatif du rendement entre hydrogène et batterie lithium
- Comment une batterie lithium peut prendre feu ?
Ecrire un commentaire
Avis Electrique
(Tri par ordre de longueur de l'avis)
Avis Electrique
(Tri par ordre chronologique)
Fiches techniques voitures électriques
Sondage au hasard :
Combien vous a coûté votre dernière révision ?
Sujets pris au hasard